¿Qué elementos son isótopos?
Hemera Technologies/PhotoObjects.net/Getty Images
Todos los elementos son isótopos. Aunque todos los átomos de un elemento dado tienen el mismo número atómico (número de protones), el peso atómico (número de protones y neutrones juntos) varía. El término "isótopo" se refiere a esta variación en el peso atómico; dos átomos con el mismo número de protones y diferente número de neutrones son dos isótopos del mismo elemento.
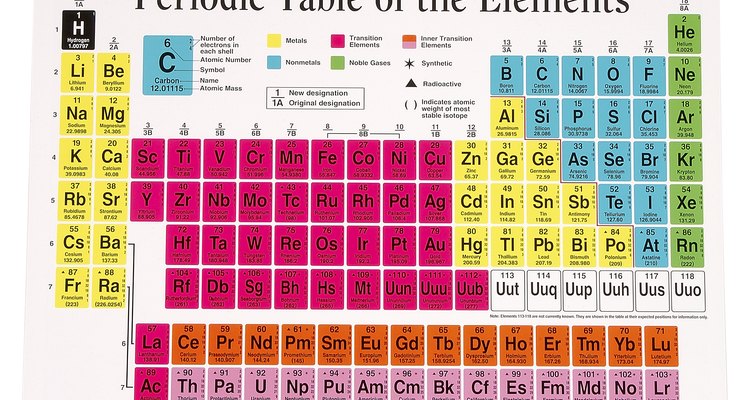
Número atómico
Los protones son partículas cargadas de forma positiva en el núcleo de un átomo. Un átomo, como un todo, tiene una carga neutral, así que cada protón con carga positiva es equilibrado por una partícula de carga negativa. Estas partículas negativas, electrones, orbitan fuera del núcleo. La configuración orbital de los electrones determina la reacción y enlace a otros átomos de ese átomo, dadas las características físicas y químicas específicas de cada elemento. Cada elemento tiene un número atómico único impreso sobre la abreviatura química en la tabla periódica.
Peso atómico
Los neutrones son partículas subatómicas que no tiene ninguna carga, así que el número de un neutrones en el núcleo de un átomo no afecta al número de electrones o su configuración orbital. Dos átomos con el mismo número de protones y diferente número de neutrones tendrán las mismas propiedades físicas y químicas, pero diferentes pesos atómicos. Estos dos átomos son diferentes isótopos del mismo elemento. Por ejemplo, el isótopo más común del hidrógeno es el H-1, lo que significa que el átomo tiene un protón y ningún neutrón, pero los isótopos H-2 y H-3 también existen, con uno y dos neutrones, respectivamente. La tabla periódica da un peso atómico promedio del elemento debajo del símbolo químico del elemento.
Isótopos radiactivos
Los isótopos más pesados de un átomo son frecuentemente inestables y se dividen en isótopos más ligeros con el tiempo. Esta decadencia atómica libera energía en forma de radiación alfa, beta y gama. El hidrógeno-3, por ejemplo, es radioactivo y se separa en hidrógeno-2. Todos los elementos tienen isótopos radiactivos que decaen a diferentes casas. La tasa de decadencia se mide en vidas medias, la cantidad de tiempo que requiere que la mitad de los isótopos radiactivos en una muestra de un elemento dado decaiga en isótopos más ligeros. La vida media para el hidrógeno-3 es de 12,32 años.
Usos para los isótopos radiactivos
Los investigadores y los profesionales médicos hacen un uso extensivo de los isótopos radiactivos. Midiendo la cantidad del isótopo radioactivo de ocurrencia natural del carbono-14, los arqueólogos y los paleontólogos pueden determinar la edad aproximada de un fósil o un artefacto. Los médicos utilizan los isótopos del yodo-131 y el bario-137 como rastreadores radiactivos para detectar problemas cardíacos, tumores cerebrales y otras anormalidades, y el cobalto-60 sirve como fuente de radiación para detener el desarrollo de tumores cancerosos.
Más artículos
Diferencia entre átomos, iones, moléculas y compuestos→

Características del neón→

Cómo calcular el consumo de corriente de un amplificador de potencia a partir de la potencia de salida→

Cómo encontrar el número de neutrones en un átomo→

Elementos con configuración de gas noble→

Cómo convertir la lectura de celda de carga en peso total→

Referencias
Sobre el autor
David Samson has been contributing since 1999 under various pseudonyms to a number of underground avant-garde/punk magazines, including "The Bourgeois-Geist" and "Medatrocity." He has a Bachelor of Arts in English from the University of Texas at Austin, and also works as a freelance writing tutor.
Créditos fotográficos
Hemera Technologies/PhotoObjects.net/Getty Images
